服務領域
service


《GMP》對制藥企業生產廠房的總體要求
時間:2019-11-26
廠址選擇
在條件可能的情況下,盡量選在周轉環境較清潔和綠化較好的地區,并盡量遠離鐵路、公路、機場(尤其是防振要求高的潔凈室),與交通干道之間的距離不宜小于50cm。不要選在多風沙的地區和有嚴重灰塵、煙氣、腐蝕性氣體污染的工業區。若條件不允許,必須位于工業污染或其它人為灰塵較嚴重的地區時,要在其全年主導風向的上風側。
不論是新建或改建的潔凈車間周圍都要進行綠化,車間四周應設消防車道,廠區的路面盡量選用堅固、起塵少的材料。
工藝布置
在不影響生產情況下,為了減少交叉污染和便于系統布置,盡量將潔凈度要求相同的潔凈室安排在一起。潔凈室內只布置必要的工藝設備,容易產生灰塵和有害氣體的工藝設備或輔機盡量布置在潔凈室的外部。在同一潔凈室內,盡量將潔凈度要求高的工序布置在潔凈氣流首先到達的區域,容易產生污染的工序布置在靠近回、排風口的位置。
建筑要求
潔凈室的位置要盡量設在人流少的地方,人流方向要由低潔凈度的潔凈室向高一級的潔凈室過渡,在潔凈室內一般采用上送下回方式。
上送上回方式雖然在某些空態測定中可能達到設計潔凈度級別,但在動態時很不利于排除污染,所以是不宜推薦的方式,這是因為:
(1)上送上回容易形成某一高度上某一區域氣流趨向停滯,當使微粒的上升力和重力相抵時,易使大微粒(主要是5μm微粒)停留在某一空間區域,所以不利于排除塵粒和保證工作區工作風速(對于局部百級);
(2)容易造成氣流短路,使一部潔凈氣流和新風不能參與全室的作用,因而降低了潔凈效果和衛生效果;
(3)容易使污染微粒在上升排出過程中污染其經過的操作點,在潔凈走廊由于沒有操作點,如用上回則一般不存在這種危險,在其兩邊房間之間沒有特別的交叉污染的條件下,采用上送上回方式是可以允許的——僅指30萬級的低要求潔凈室采用。
藥品生產企業的廠房與設施是指制劑、原料藥、藥用輔料和直接接角藥品的藥用包裝材料生產中所需的建筑物以及與工藝配套的公用工程。
藥品生產企業為了消除混藥和污染,或將這種可能性降至最低,必須要有整潔的生產環境及與所生產醫藥用品相適應的廠房設施,這包括規范標準化廠房以及相配套的凈化空氣處理系統、照明、通風、水、氣體、洗滌與衛生設施、安全設施等。這里講的制藥生產企業的廠房與設施就是指藥品生產所需的環境保證條件。
因為廠房與設施是藥品生產的根本條件,是實現《GMP》的“硬件”,WHO及各國的GMP中均有廠房設施專門的章節;我國的《GMP》1999年修訂版亦對廠房與設施條件做了具體要求。
藥品生產企業為了防止來自各種渠道的污染,采取了 多方面的污染控制措施。普遍采用潔凈技術,并初步形成了綜合性的潔凈技術體系作為潔凈室的主要組成部分。空氣凈化是極為重要的,它與潔凈室的建筑設計有著極為密切的相互依存關系。純水及高純工業氣體也是經常遇到,它們雖各有其可以安置在潔凈廠房外的獨立制備工藝,但往往由于生產中的種種特定條件,其使用點一般均在潔凈室內。
美國宇航標準中的潔凈度級別表 表一
級別 | 微粒 | 生物微粒 | |||||
粒徑 | 最大數量 | 浮游最大數量 | 沉降量 | ||||
(μm) | (粒/ft3) | (粒/L) | (粒/ft3) | (粒/L) | (粒/ft3·周) | (粒/ | |
100 | 100 | 3.5 | 0.1 | 0.0035 | 1200 | 12900 | |
10000 | ≥0.5 | 10000 | 350 | 0.5 | 0.0176 | 6000 | 64600 |
≥0.5 | 65 | 2.5 | |||||
100000 | ≥0.5 | 100000 | 3500 | 2.5 | 0.0884 | 30000 | 323000 |
≥0.5 | 700 | 25 | |||||
1978年國際空氣潔凈度標準(草案) 表二
級 別 | 空氣中生物和非生物微粒總數≥0.5μm微粒的最大數量 | 空氣中生物微粒單位容積空氣中活性菌落最大數量 | 表面生物微粒沉降菌落最大數量 | |||
(ft3) | (L) | (ft3) | (L) | (粒/ft2·d) | (粒/m2·周) | |
1 | 不控制 | 不控制 | 不控制 | |||
2 | 100000 | 3500 | 2.5 | 0.0884 | 200 | 323000 |
3 | 10000 | 350 | 0.5 | 0.0176 | 40 | 64600 |
4 | 100 | 3.5 | 0.1 | 0.0035 | 8 | 12900 |
5 | 10 | 0.35 | 0.04 | 0.0014 | 3 | 5200 |
美國聯邦標準從209C開始一直到209E都明確提出空氣潔凈度級別和生物微粒之間還沒有建立起確定的關系,都沒有給出和微粒總數相對應的生物微粒數量的規定。由于生產的需要,從209C開始出了比100級更高的級別——0.5μm10級、1級或者0.1μm 10級、1級。
美國聯邦標準209E 表三
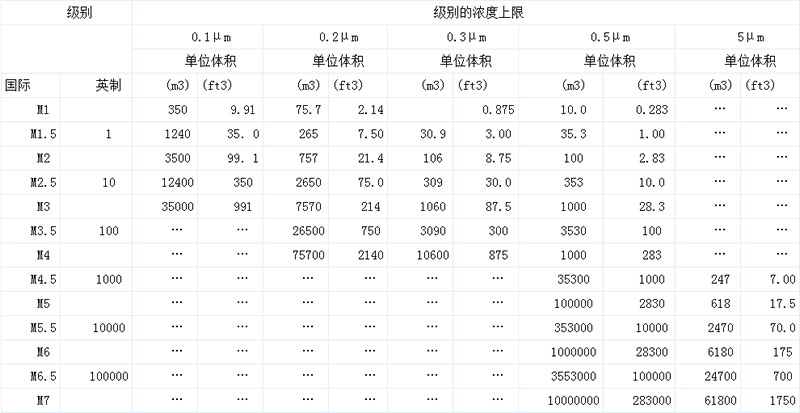
關于工業用潔凈室方面的指南、規定、標準參考資料、解說和實際用例,我國過去已經發表介紹了許多。空氣中的懸浮塵埃的控制技術,70年代初期在我國藥品生產企業運用中還是先進技術,而現在已從一般塵埃的控制轉變到生物微粒的控制。目前在生物凈化的名義下,正以醫院為中心,向著新的領域繼續發展,形成了生物潔凈技術。
在藥品生產企業潔凈室的發展過程中,1950年高效過濾器的研制,1962年層流(現在稱單向流)概念在潔凈室方面的應用以及1963年美國聯邦標準209的發表,都是很大的技術革新。若沒有高效過濾器的發展,便無法以用0.5um懸浮塵粒來規定空氣潔凈度(附表三)。
水與工業氣體在藥品生產上都普遍使用,它們或者與產品多次接觸,或者直接參與產品的化學、物理過程,它們的純凈程度往往要比空氣潔凈程度對于產品質量有更加直接的影響。
上一篇:制藥工業要求的室內環境計算參數
下一篇:GMP潔凈廠房設計要求與計算公式